Obecnie za sprawą szczepionki przeciwko wirusowi SARS-CoV-2, w mediach pojawia się wiele informacji dotyczących wprowadzania leków na rynek oraz badań klinicznych. Niektóre z informacji mogą być niezrozumiałe. Niestety w toku studiów na kierunku lekarsko-dentystycznym nie mamy podawanych zbyt wiele informacji związanych z wprowadzaniem leków na rynek. Temat ten jest jednak niezwykle interesujący, dlatego też w 2019 roku postanowiłam rozpocząć studia podyplomowe właśnie z badań klinicznych. Mam nadzieję, że ten artykuł pomoże Wam lepiej zrozumieć zagadnienia związane z badaniami klinicznymi.
Czym jest lek?
Produktem leczniczym – jest substancja lub mieszanina substancji, przedstawiana jako posiadająca właściwości zapobiegania lub leczenia chorób występujących u ludzi lub zwierząt lub podawana w celu postawienia diagnozy lub w celu przywrócenia, poprawienia lub modyfikacji fizjologicznych funkcji organizmu poprzez działanie farmakologiczne, immunologiczne lub metaboliczne.
art. 2. ust 32 ustawy z dnia 6 września o prawie farmaceutycznym ( tj. Dz.U.2020.944 t.j.)
Na początku chciałabym byśmy się zastanowili, czym właściwie jest lek. Dobrze nam znane pojęcie leku, w prawie zastąpione zostało określeniem produkt leczniczy. Jak możemy przeczytać w definicji z ustawy Prawo Farmaceutyczne, produkt leczniczy jest to substancja odpowiednio przebadana, posiadająca właściwości zapobiegania lub leczenia chorób u ludzi lub zwierząt. Bardzo ważne w tej definicji są słowa „odpowiednio przebadana”. By móc wprowadzić produkt leczniczy na rynek, należy przebadać go wykonując szereg badań klinicznych. Należy jednak pamiętać, że nie wszystkie produkty sprzedawane w aptece są produktami leczniczymi. 1
Co nie jest uznawane za produkt leczniczy?
Suplement diety to środek spożywczy, którego celem jest uzupełnienie normalnej diety, będący skoncentrowanym źródłem witamin lub składników mineralnych lub innych substancji wykazujących efekt odżywczy lub inny fizjologiczny, pojedynczych lub złożonych, wprowadzany do obrotu w formie umożliwiającej dawkowanie, w postaci: kapsułek, tabletek, drażetek i w innych podobnych postaciach, saszetek z proszkiem, ampułek z płynem, butelek z kroplomierzem i w innych podobnych postaciach płynów i proszków przeznaczonych do spożywania w małych, odmierzonych ilościach jednostkowych, z wyłączeniem produktów posiadających właściwości produktu leczniczego w rozumieniu przepisów prawa farmaceutycznego.
art. 3 ust.3 pkt 39 ustawy z dnia 25 sierpnia 2006 r. o bezpieczeństwie żywności i żywienia (t.j. Dz. U. z 2015 r. poz. 594)
Wyrób medyczny - narzędzie, przyrząd, urządzenie, oprogramowanie, materiał lub inny artykuł, stosowany samodzielnie lub w połączeniu, w tym zoprogramowaniem przeznaczonym przez jego wytwórcę do używania specjalnie w celach diagnostycznych lub terapeutycznych i niezbędnym do jego właściwego stosowania, przeznaczony przez wytwórcę do stosowania u ludzi (…) który nie osiąga zasadniczego zamierzonego działania w ciele lub na ciele ludzkim środkami farmakologicznymi, immunologicznymi lub metabolicznymi, lecz którego działanie może być wspomagane takimi środkami;
Art. 2 ust, 38 Ustawa z dnia 20 maja 2010 o wyrobach medycznych
Wyrób medyczny do implantacji – wyrób medyczny przeznaczony do wprowadzania w całości do ludzkiego ciała albo zastępowania powierzchni nabłonka lub powierzchni oka, za pomocą zabiegu chirurgicznego, i pozostający tam po zakończeniu zabiegu oraz wyrób medyczny przeznaczony do wprowadzania w części do ludzkiego ciała, za pomocą zabiegu chirurgicznego, i pozostający tam po zakończeniu zabiegu co najmniej przez 30 dni
Art. 2. ust. 40 Ustawa z dnia 20 maja 2010 o wyrobach medycznych
Za produkty lecznicze nie uznaje się m.in. suplementów diety czy wyrobów medycznych. Suplementy diety w swoim wyglądzie mogą łudząco przypominać produkty lecznicze. Są one powszechnie dostępne. Do suplementów diety zaliczymy witaminy, minerały lub ich mieszanki, stworzone by np. wspierać naszą pamięć czy poprawiać kondycję naszych włosów. Pomimo, że suplementy są sprzedawane nawet w sklepach spożywczych, warto dokładnie czytać ich skład.
Wyroby medyczne to kolejna bardzo obszerna grupa produktów, których nie klasyfikuje się jako produkty lecznicze. Najogólniej ujmując wyroby medyczne to wszelkie instrumenty, materiały a nawet oprogramowanie używane w celach diagnostycznych lub terapeutycznych. My jako stomatolodzy również korzystamy z wyrobów medycznych takich jak np. fotel stomatologiczny czy aparatura RTG. Wyroby medyczne implementowane to grupa wyrobów medycznych, która jest wprowadzana do ciała podczas zabiegu. W stomatologii są nimi implanty zębowe. Ich powierzchnie mogą być pokryte lekiem, lecz same wyroby implementowane nie wykazują działania farmakologicznego. Również niektóre środki do higieny jamy ustnej są wyrobami medycznymi np. pasta elmexⓇ Sensitive Professional (https://www.colgateprofessional.pl/products/products-list/elmex-sensitive-professional-toothpaste).
Co bardzo istotne w naszych dzisiejszych rozważaniach, suplementy diety oraz wyroby medyczne nie podlegają tym samym zasadom dotyczącym rejestracji, jakim podlegają produkty lecznicze. 3,4
Czy produkty do jamy ustnej są lekami?
Większość produktów stosowanych w jamie ustnej nie jest klasyfikowana za produkty lecznicze. Dotyczy to zarówno materiałów stosowanych w gabinecie, jak również środków do higieny jamy ustnej. Za produkty lecznicze klasyfikuje się np. zawiesinę fluorkową ColgateⓇ DuraphatⓇ 50 mg/ml ( https://www.colgateprofessional.pl/products/products-list/colgate-duraphat-lakier-fluorowy?cq_ck=1614859666652 ) oraz pastę do zębów ColgateⓇ DuraphatⓇ 5000 ( https://www.colgateprofessional.pl/products/products-list/colgate-duraphat-5000-toothpaste) Lakier Duraphat został wprowadzony na rynek już w 1964 roku i może być wykorzystywany w profilaktyce próchnicy oraz leczeniu nadwrażliwości. W charakterystyce produktów leczniczych możemy znaleźć informacje na temat m.in. farmakodynamiki i farmakokinetyki leku czy przechowywania. 4-7
Jak wygląda wprowadzanie produktu leczniczego na rynek?
Proces dopuszczania leku na rynek jest ściśle uregulowany. Zanim lek będzie można zakupić w aptece, musi być odpowiednio przebadany. Najogólniej proces ten można podzielić na dwa etapy: badania przedkliniczne i badania kliniczne. Zanim jakikolwiek człowiek otrzyma badany lek, produkt testowany jest na zwierzętach. Jest to faza badań przedklinicznych. Niestety organizm człowieka jest na tyle złożony i odmienny od organizmu innych gatunków, że badania laboratoryjne oraz badania na zwierzętach nie są wystarczające, by uznać lek za bezpieczny.
Dlatego też konieczne jest przeprowadzenie drugiej części badań nad lekiem, czyli badań klinicznych. 9
Czym są badania kliniczne?
Badaniem klinicznym - jest każde badanie prowadzone z udziałem ludzi w celu odkrycia lub potwierdzenia klinicznych, farmakologicznych, w tym farmakodynamicznych skutków działania jednego lub wielu badanych produktów leczniczych, lub w celu zidentyfikowania działań niepożądanych jednego lub większej liczby badanych produktów leczniczych, lub śledzenia wchłaniania, dystrybucji, metabolizmu i wydalania jednego lub większej liczby badanych produktów leczniczych, mając na względzie ich bezpieczeństwo i skuteczność;
art. 2. ust 32 ustawy z dnia 6 września o prawie farmaceutycznym ( tj. Dz.U.2020.944 t.j.)
Badania kliniczne to badania z udziałem ludzi, mające na celu sprawdzenie działania produktów leczniczych. Badania kliniczne możemy podzielić na komercyjne i niekomercyjne. W badaniach komercyjnych dane z badania mają na celu wprowadzenie leku na rynek lub poszerzenia wskazań do jego stosowania. Koszty tych badań ponoszone są zwykle przez koncerny farmaceutyczne. Badania kliniczne niekomercyjne – przeprowadzane są bardzo często przez instytucje publiczne np. Uniwersytety. Wyników z tych badań nie można wykorzystywać w celach rejestracyjnych. 1,8-9
Jakie są normy prawne dotyczące badań klinicznych?
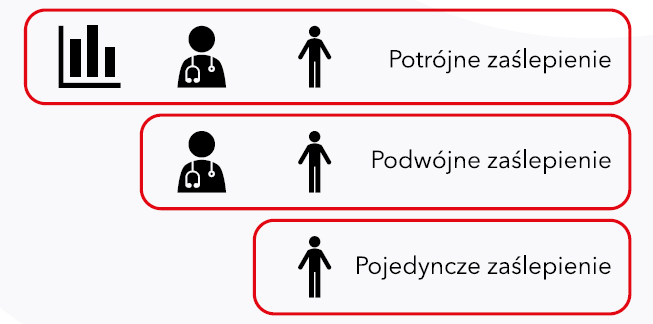
Tragiczna historia eksperymentów podczas II wojny światowej oraz innych wydarzeń z historii medycyny, ukształtowała obecne prawo dotyczące badań klinicznych. W 1964 roku została uchwalona deklaracja helsińska. Jest to dokument określający zasady prowadzenia medycznych badań naukowych. Dokument ten stanowi podwaliny dla prawa międzynarodowego, jak i prawa poszczególnych krajów w odniesieniu do badań klinicznych takich jak standardy GCP (ang. Good Clinical Practice), czy polskie przepisy. Przepisy dotyczące badań klinicznych regulują min. w jaki sposób powinna być przekazywana informacja o badaniu pacjentowi, kto może brać udział w badaniu, jakie zgody są wymagane, jaki powinien być skład komisji bioetycznych. Co bardzo istotne wszystkie badania kliniczne muszą uzyskać zgodę odpowiedniej komisji bioetycznej. Nad bezpieczeństwem i kontrolą badań klinicznych przeprowadzanych na terenie naszego kraju czuwa Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. 9-10
Jak wygląda struktura badań klinicznych?
Najogólniej ujmując w badaniu klinicznym możemy wyróżnić 3 strony:
Badacz - jest to osoba, która prowadzi i nadzoruje badania kliniczne w danym ośrodku. Może nim być lekarz lub lekarz-dentysta (w przypadku, gdy badanie dotyczy stomatologii), który posiada prawo wykonywania zawodu na terenie Rzeczypospolitej Polskiej oraz odpowiednio wysokie kwalifikacje i doświadczenie zawodowe w pracy z pacjentami. Prawodawca jednak nie określa co oznacza zwrot „odpowiednio wysokie kwalifikacje”. Badacze odpowiadają za dostarczenie informacji na temat skuteczności stosowanego leku oraz odpowiedniego raportowania skutków niepożądanych.
Sponsor - którym jest najczęściej firma farmaceutyczna lub w przypadku badań niekomercyjnych np. instytucja naukowa. Sponsor badania pokrywa wszelkie koszty związane z przeprowadzeniem badania klinicznego, w tym również odpowiednie wynagrodzenie dla badaczy.
Ośrodek badawczy - jest to placówka ochrony zdrowia, w której przeprowadzane jest dane badanie kliniczne. Podlega również kontroli Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, co zapewnia bezpieczeństwo, rzetelność i wiarygodność badań klinicznych. 9-10
Jak wyglądają poszczególne etapy badań klinicznych?
Badania kliniczne możemy podzielić na cztery fazy.
Badania I fazy - wstępne badania, mające na celu sprawdzenie bezpieczeństwa oraz właściwości farmakologiczne leku. Uczestnikom podaje się lek w dawce terapeutycznej. Badanie to wykonywane jest na grupie około 50 – 100 zdrowych ochotników. W niektórych przypadkach, gdy mówimy np. o lekach cytotoksycznych stosowanych w leczeniu nowotworów, lek podaje się osobom chorym.
Badania II fazy – wykonywane w celu ustalenia dawki terapeutycznej oraz wstępnej analizie bezpieczeństwa i skuteczności leku. W tej fazie po raz pierwszy dzieli się pacjentów na grupę badaną i kontrolną. Badania II fazy obejmują zwykle 300 – 600 ochotników, chorujących na leczoną dolegliwość.
Badanie III fazy – wykonywane w celu potwierdzenia bezpieczeństwa i skuteczności leku. Bierze w nich udział na ogół od 1000 do 3000 chorych uczestników. Również w tym przypadku istnieje podział na grupę kontrolną i badaną. Jest to najdłuższy i najbardziej kosztowny etap badań klinicznych.
Rejestracja - po pomyślnym ukończeniu badań III fazy można rozpocząć rejestrację leku. W Unii Europejskiej naczelnym organem rejestrującym lek jest EMA (ang. European Medicines Agency) w Stanach Zjednoczonych natomiast FDA (ang. Food and Drug Administration).
Badania IV fazy – są to nieinterwencyjne badania po rejestracji leku. U ich uczestników nie zmienia się stosowanej terapii, a jedynie obserwuje i odnotowuje skuteczność i ew. działania niepożądane. Nie występuje tu również grupa kontrolna. Ta faza ma na celu potwierdzenie długoterminowej skuteczności oraz bezpieczeństwa leku. Co ważne podczas badań IV fazy lek może być już dostępny w aptekach. Wyniki tej fazy badań mogą być wykorzystane do rozszerzenia wskazań rejestracyjnych leku.
Obecnie coraz częściej przeprowadza się tzw. fazę 0 polegającą na podaniu mikrodawek leku zwykle kilku ochotnikom. Celem tej fazy jest wstępne sprawdzanie farmakokinetyki badanej substancji. 9-10
Czym jest grupa kontrolna?
W badaniach II i III fazy część pacjentów przypisana jest do grupy kontrolnej. Grupa kontrolna kojarzy nam się zwykle z osobami przyjmującymi placebo i rzeczywiście w części przypadków jest to prawda. Jednakże w niektórych badaniach grupę kontrolną stanowią pacjenci przyjmujący inny lek. Dzieje się tak w przypadku, gdy znany jest już lek na daną chorobę, a badania mają na celu np. potwierdzić wyższą skuteczność nowej terapii. W takiej sytuacji nieetyczne byłoby pozostawienie pacjentów z grupy kontrolnej bez odpowiedniej pomocy. W takich badaniach pacjenci z grupy badanej przyjmują testowany lek, natomiast pacjenci z grupy kontrolnej przyjmują lek obecny już na rynku, zwykle jest to standard terapii. Przeprowadzane są również badania kliniczne, w których pacjenci z grupy kontrolnej i badanej przyjmują ten sam lek lub leki, natomiast różnią się one dawką lub sposobem podawania. 9-10,12
W jaki sposób wybierani są pacjenci do poszczególnych grup?
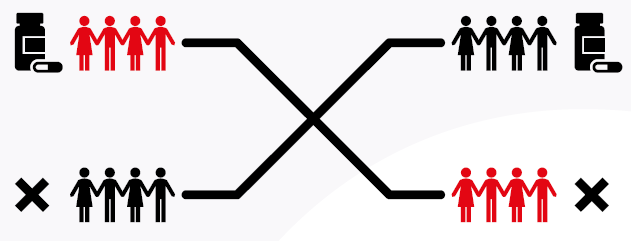
Przydział pacjentów do grupy badanej lub kontrolnej jest zwykle randomizowany. Oznacza to, że pacjenci przydzielani są do konkretnej grupy w sposób losowy. Najczęściej badania prowadzone są równolegle. Pacjent przydzielony jest na cały czas trwania badania do jednej z grup np. grupy kontrolnej lub grupy badanej. Zdarza się jednak, że pacjent należy do dwóch grup. Szczególnie często takie badania medyczne możemy spotkać w stomatologii, gdy np. testowane są terapie na dwóch zębach jednoimiennych, znajdujących się po przeciwnych stronach łuku. Są to najczęściej badania potwierdzające skuteczność danej techniki leczenia niż samych leków.
Bywa również, że na początku badania klinicznego pewna grupa pacjentów (grupa A) otrzymuje lek, natomiast pozostali pacjenci (grupa B) otrzymują placebo. Po odpowiednim czasie, następuje przerwa, która ma na celu oczyszczenie organizmów z leku. Następnie grupy zamieniają się. Wcześniejsza grupa badana (grupa A) będzie otrzymywała placebo, natomiast grupa pierwotna kontrolna (grupa B) otrzyma badany lek. Są to tak zwane badania eksperymentalne naprzemienne (ang. crossover study). 9-10